La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) anunció que el Comité de Moléculas Nuevas (CMN) evaluó de manera positiva la información técnica y científica presentada por Avi-Mex S.A. de C.V, en relación con su vacuna AVX/COVID-12 contra el virus SARS-CoV-2, causante de la COVID-19.
La opinión favorable emitida por el CMN para la vacuna AVX/COVID-12, basada en la plataforma recombinante NDV y destinada a la inmunización activa de personas mayores de 18 años por vía intramuscular, representa un paso crucial hacia la posible obtención de la autorización para uso de emergencia, siempre y cuando se cumplan exitosamente todas las etapas del proceso.
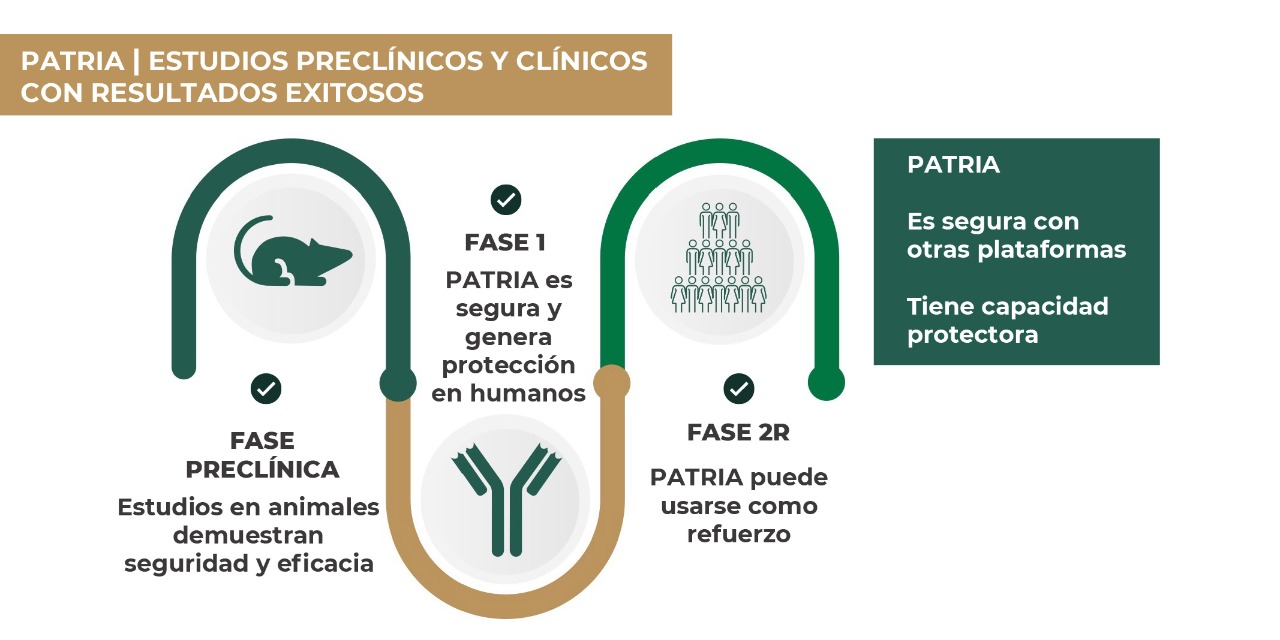
El CMN destacó que los datos de inmunogenicidad proporcionados por Avi-Mex indican que la vacuna Patria muestra una efectividad equivalente a la de otros biológicos ya aplicados en la población, respaldada por información preclínica y ensayos clínicos presentados durante la sesión.Dada la novedad del insumo, los expertos subrayaron la necesidad de un riguroso esquema de farmacovigilancia para evaluar el perfil de seguridad a largo plazo.
El panel de expertas y expertos consideró que este biológico podría facilitar la aplicación universal y el acceso a vacunas para toda la población del país, ya que su cadena de frío de dos a ocho grados centígrados permite llegar a zonas remotas, a diferencia de otros insumos que requieren cadenas de frío más complejas.
La sesión estuvo presidida por el coordinador del CMN, Carlos Jerjes Sánchez Ramírez, la secretaria técnica del Subcomité de Biológicos, Armida Zúñiga Estrada, y la suplente del secretario técnico del CMN, Gabriela Huitrón Ramírez.
Entre los expertos convocados se encontraban: Arturo Reyes Sandoval, Miguel Ángel Jorge Guevara Fonseca, Sergio Ponce de León Rosales, Lena Ruiz Azuara y Rosana Pelayo Camacho. Además, como invitados participaron las dictaminadoras de la Comisión de Autorización Sanitaria (CAS) de Cofepris: Beatriz Guzmán Soriano y Gabriela Hernández Chávez, Lizet Paola Romero Luna, junto con la dictaminadora del Centro Nacional de Farmacovigilancia, Paola Elena González Martínez.
Cofepris destaca que el CMN es un órgano auxiliar de consulta dentro de la agencia reguladora y su función es emitir opiniones técnicas no vinculantes sobre medicamentos e insumos para la salud, basándose en la evidencia científica y médica presentada. Esta etapa no es la autorización final para usar emergencia.